生きた細胞の膜のナノ形状・流動性を同時計測可能な光学顕微法を開発ー膜物性の差ががん細胞悪性度の指標になることを発見ー
2025年1月14日
研究成果のポイント
- 従来まで困難であった、生きた細胞の膜のナノ形状や流動性を同時に計測可能な光学顕微法を開発。細胞膜の流動性が、細胞種ごとや、接着領域と非接着領域の間で顕著に異なることを発見。
- 特に、悪性度の高いがん細胞では、正常細胞の膜とは違った特徴があり、コレステロールや不飽和脂肪酸の合成阻害によりこの特徴が小さくなることを発見。
- 私たちの体を構成する細胞は、細胞膜と呼ばれる流動的な薄い膜で覆われており、細胞膜を介して他の細胞や外部環境と接着することで様々な生命現象が起こる。しかしこれまで、生細胞の膜の形状や流動性を正確に同時計測することは困難だった。
- 細胞の膜物性と接着との相関が明らかとなり、細胞膜が関わる様々な生命現象(がん転移、臓器形成など)のメカニズム解明に繋がると期待できる。
概要
大阪大学大学院工学研究科の吉川洋史教授、松﨑賢寿助教、埼玉大学の中林誠一郎名誉教授、菅沼雅美教授(研究当時)、川村隆三准教授、滋賀県立大学の小林成貴准教授(研究当時:埼玉大学・助教)らの研究グループは、生きた細胞の膜のナノ形状と流動性を同時可視化する光学顕微法を開発しました。これを用いることで、細胞の接着領域と非接着領域の膜流動性※1が異なることを発見したとともに、この膜流動性の差ががん細胞悪性度の指標となりえることを見出しました。
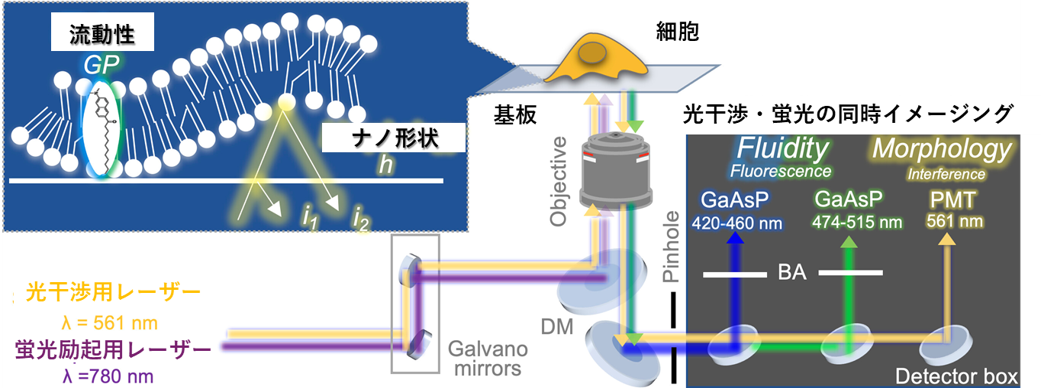
図1:本研究で開発した光干渉計測と蛍光計測を組み合わせた光学顕微法
これまで細胞膜の接着や物性の計測では、膜を複数の蛍光分子でラベル(色付け)することが一般的でした。しかし、蛍光分子が相互に影響することで計測が阻害されること、生きた細胞においては膜を複数の蛍光分子でラベルすることが難しいこと、また細胞膜に作用する引力の一部(例:静電引力)は蛍光分子でラベルすることが困難であるという課題がありました。
今回、研究グループは、光干渉計測と蛍光計測を組み合わせて使うことにより、生細胞の膜のナノ形状と流動性を同時計測可能であることを見出しました。これにより、細胞膜の接着・変形・流動性の相関が明らかとなり、細胞膜が関わる様々な生命現象(がん転移、臓器形成など)のメカニズム解明に貢献することが期待されます。
本研究成果は、米国科学アカデミー紀要「Proceedings of the National Academy of Sciences of the United States of America」に、12月6日(金曜日)(日本時間)に公開されました。
研究の背景
生物の最小単位である細胞は、細胞膜と呼ばれる流動的な薄い膜で覆われています。細胞は、この細胞膜を介して他の細胞などの外部環境と接着することで、がん転移などの病気や、臓器のような多細胞組織の形成が進行されます。よって細胞と外部環境との接着が、細胞膜によりどのように制御されているかを明らかにすることは、生命科学や医学分野において大変重要です。
これまでにも、細胞の膜と接着との関係性に着目した研究が数多く報告されています。例えば、細胞は外部環境との接着に際して、細胞膜をナノメートルスケールでダイナミックに変形させており、また細胞膜を構成する分子の配列・組成や流動性も大きく変動しうることが報告されています。これらの細胞膜の計測においては、細胞膜を複数の蛍光分子によりラベル(色付け)し、それにより細胞膜の接着・変形・流動性などを計測する方法が主流でした。しかし、複数の蛍光分子が相互に影響することで計測が阻害され、さらに生きた細胞においてはそもそも膜を複数の蛍光分子でラベルすることが難しいことから、生細胞の膜の形状や物性を正確に同時計測することは困難でした。また、蛍光計測では、蛍光ラベルが容易な生体分子同士の強い結合(鍵-鍵穴結合など)は可視化できますが、蛍光ラベルが困難な物理的な引力(静電引力など)を介した細胞接着は検出できず、細胞膜の接着領域全体を計測できていないという課題がありました。
研究の内容
研究グループでは、光干渉計測と蛍光計測を組み合わせることで、生きた細胞の接着面の膜流動性を可視化する手法論を開発しました(図1)。ここではまず、細胞膜と外部環境(平面基板)との接着を蛍光ラベル無しで検出するために、反射型光干渉顕微法(Interference Reflection Microscopy, IRM)※2を用いて細胞膜のナノ形状を計測しました。本手法は、細胞膜と基板からの反射光の干渉パターンを検出することで、細胞膜のナノ形状を膜ー基板間の距離として情報を得るものです。これにより、接着の起源となる引力(例:生体分子間の結合、静電引力など)を問わず、細胞膜と基板との物理的な接触(接着)を検出することができます。また本研究では、この光干渉計測と同時に、細胞膜の流動性に応答する分子(Laurdan※3)を蛍光計測できるように顕微鏡を改造しました。反射光と蛍光は、波長などの検出原理が全く異なることから、お互いの計測を阻害しません。これにより、従来の蛍光のみを用いる計測法では困難であった、生きた細胞の膜のナノ形状と流動性を同時計測することが可能になりました。
研究グループは、この開発した顕微法を用いて、細胞膜の接着面および非接着面の膜流動性を評価することを試みました。まず人工的に作製した細胞膜のモデル(Giant Unilamellar Vesicle)を調べたところ、基板に対して接着している領域の膜は、接着していない領域と比べて膜の流動性が高いことがわかりました(図2)。続けて研究グループは、乳腺由来の細胞の膜を同じ手法で計測したところ、人工細胞膜モデルと同様に、接着領域の細胞膜の流動性が高いことを発見しました(図3)。また興味深いことに、悪性度の高いがん細胞では、(1)細胞外周部に膜流動性が低い領域が存在する、(2)膜の場所ごとで流動性の振れ幅が大きい、という特徴を発見しました。さらに膜流動性に大きく影響することが知られているコレステロールや不飽和脂肪酸の合成を阻害すると、上記(1)(2)の特徴が小さくなることがわかりました。
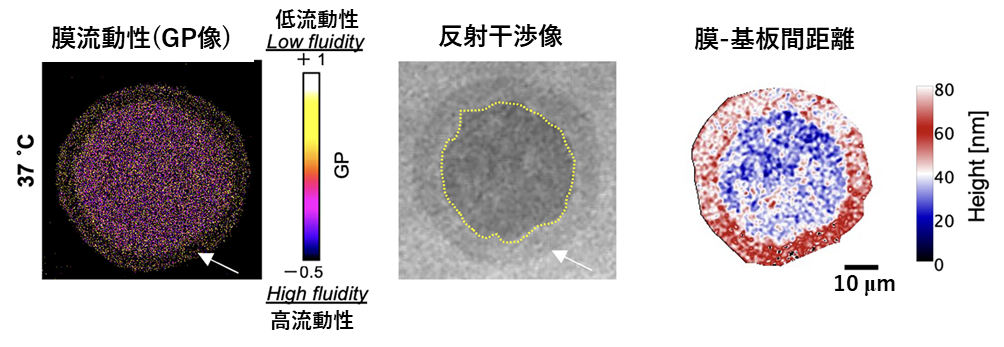
図2:人工細胞膜モデルの膜流動性(左)と、光干渉像(中)から計算で得られた膜底面のナノ形状(右)
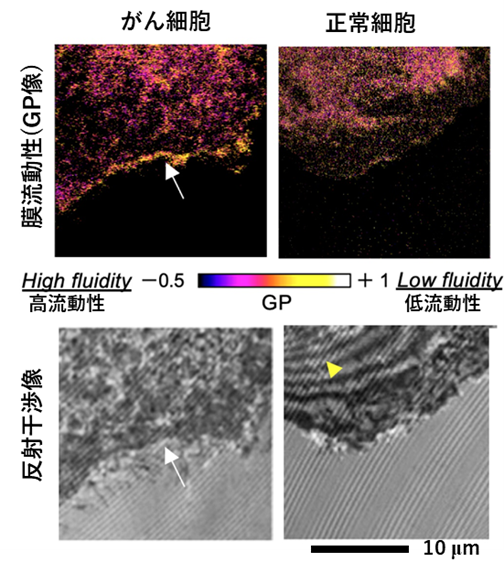
図3:がん細胞および正常細胞の膜流動性(上)と接着面の光干渉像(下)
本研究成果が社会に与える影響(本研究成果の意義)
本研究で開発した光学顕微法を用いることで、従来の蛍光顕微法のみでは難しかった、細胞膜の接着・変形・流動性の関係性を明らかにできることがわかりました。今後本手法を駆使することにより、細胞膜物性を指標としたがん細胞の悪性度の評価や薬剤開発、さらには細胞膜の物性が臓器形成に与える影響の解明など、細胞膜が重要な役割を果たす生命現象のメカニズム解明や医学応用への貢献が期待されます。
特記事項
本研究成果は、2024年12月6日(金曜日)(日本時間)に米国科学アカデミー紀要「Proceedings of the National Academy of Sciences of the United States of America」(オンライン)に掲載されました。
タイトル:"Simultaneous visualization of membrane fluidity and morphology defines adhesion signatures of cancer cells"
著者名:Takahisa Matsuzaki*, Mai Fujii, Hayata Noro, Shodai Togo, Mami Watanabe, Masami Suganuma, Shivani Sharma, Naritaka Kobayashi, Ryuzo Kawamura, Seiichiro Nakabayashi, and Hiroshi Y. Yoshikawa*
DOI:https://doi.org/10.1073/pnas.2412914121
なお、本研究の一部は、科研費(JP21KK0195, JP23K18563, JP19KK0128, JP22H00302, JP24H01138, JP23K18576, JP24KK0106, JP21H03790)、JST創発的研究支援事業(JPMJFR205N)、武田科学振興財団、内藤記念科学振興財団、上原記念生命科学財団、天田財団、中谷財団、村田学術振興財団、旭硝子財団などの支援を受けて行われました。
用語説明
※1 膜流動性
細胞膜は、リン脂質が平面状に並んだナノメートルスケール厚みの膜を主成分として構成されています(図1左上)。細胞膜は、リン脂質が液晶のように膜の平面内を動き回ることで流動性を有し、この膜流動性がタンパク質の輸送などの重要な生命機能を担っています。膜流動性は脂質の分子構造(例:二重結合の数や位置等)や組成などに依存して変化することが知られており、膜流動性がどのように制御されているかを解明することは生命科学における重要課題です。
※2 反射型光干渉顕微法(Interference Reflection Microscopy, IRM)
2つの異なる反射光を重なり合わせる(干渉させる)ことで明暗のパターンを得る顕微計測法。本研究では、レーザーの単色光を用いて、平面基板と溶液との界面からの反射光(i1)、細胞膜と溶液との界面からの反射光(i2)の干渉を計測することで、細胞膜ー基板間の距離を反映した明暗のパターンを得ることができます(図2中央、図3下)。この明暗のパターンを解析して得られた細胞膜ー基板間距離の分布(図2右)から、細胞が基板に対して接着している個所を決定できます。本顕微法の原理は高校の物理で習うニュートンリングとほぼ同じものです。
※3 Laurdan
膜環境感受性色素とよばれる蛍光分子であり、正式名称は1-[6-(Dimethylamino)-2-naphthyl]-1-dodecanone。膜内部の存在する溶媒などの極性分子の割合に応じて、蛍光スペクトルのピークがシフトすることが知られており、膜流動性のセンサーとして広く用いられます。本研究では、異なる2つの波長領域の蛍光強度の比を計測し、それに基づいてGP(Generalized Polarization)と呼ばれる膜流動性の指標を決定しました。
吉川教授のコメント
本研究は私の前所属である埼玉大学にて開始し、様々な学生さんや先生方のご協力のお陰で形にすることができました。本研究にご協力頂いたすべての共著者の皆様に心より御礼申し上げます。
松﨑助教のコメント
Reviewer、共著者とDiscussionを深められたことがとても楽しかったです。初めての人でもわかりやすくすごさがパッとわかるそんな論文が書けるように、先生方と一緒に成長していきたいです。
SDGs目標
![]()
![]()
参考URL
- 吉川洋史教授:研究者総覧URLはこちら
- 松﨑賢寿助教:研究者総覧URLはこちら
本件に関する問い合わせ先
研究に関するお問い合わせ
- 大阪大学 大学院工学研究科 教授 吉川洋史(よしかわひろし)
E-mail:hiroshi@ap.eng.osaka-u.ac.jp - 大阪大学 大学院工学研究科 助教 松﨑賢寿(まつさきたかひさ)
TEL:06-6879-7838
E-mail:matsuzaki1@ap.eng.osaka-u.ac.jp - 埼玉大学 大学院理工学研究科 准教授 川村隆三(かわむらりゅうぞう)
E-mail:ryuzo@mail.saitama-u.ac.jp - 滋賀県立大学工学部 准教授 小林成貴(こばやしなりたか)
E-mail:kobayashi.n@e.usp.ac.jp
広報に関するお問い合わせ
- 大阪大学 工学研究科 総務課 評価・広報係
TEL:06-6879-7231
E-mail:kou-soumu-hyoukakouhou@office.osaka-u.ac.jp - 埼玉大学 総務部広報渉外課
TEL:048-858-3932
FAX:048-858-9057
E-mail:koho@gr.saitama-u.ac.jp - 滋賀県立大学 経営企画課
TEL:0749-28-8234
E-mail:keiei_kikaku@office.usp.ac.jp
(@を半角に直して送信してください)
発信先 報道機関
- 大阪大学から大阪科学・大学記者クラブ、文部科学記者会、科学記者会
- 埼玉大学から埼玉県政記者クラブ
- 滋賀県立大学から滋賀県教育記者クラブ、彦根新聞記者会




